1803年英国化学家w.亨利研究气体在液体中的溶解度时,总结出一条经验规律,“在一定的温度和压强下,一种气体在液体里的溶解度与该气体的平衡压强成正比”。该定律适用的条件是其气体的平衡分压不大,气体在溶液中不与溶剂起作用,(或起一些反应,但极少电离)。被溶解气体的数量可用不同的浓度表示,亨利定律的数学表达式可有下列几种形式:
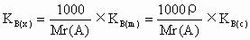 |
| 亨利常数 |
PB=kB(x)xB,PB=kB(m)mB,PB=kB(c)cB
式中xB──溶质B的摩尔分数
mB──溶质B的质量摩尔浓度,单位为mol·kg-1
cB──为溶质B的物质的量浓度,单位为mol·dm-3
KB(x),KB(m),KB(c)均称为亨利常数,它们的关系如图。三者的单位分别为1、Pa或KPa等;
2、Pa·kg/mol、KPa·kg/mol等;3、Pa·L/mol、KPa·L/mol等。
ρ为溶液密度,Mr(A)是溶剂A的相对分子质量。
亨利常数也有用单位体积中所溶解气体的体积来表示的。
由于气体溶解在液体中所构成的溶液与其他类型的溶液无区别,故该定律也适应于两种液体组成的稀溶液。
一些气体溶于水时的亨利常数
亨利常数KB(x)(kPa)(298K)
H2 N2 O2 CO2 CH4
7.12x106 8.68x106 4.40x106 1.66x106 4.18x106